lunes, 31 de marzo de 2014
EL ÁTOMO
Definimos átomo como la partícula más pequeña en que un elemento puede ser dividido sin perder sus propiedades químicas. Aunque el origen de la palabra átomo proviene del griego, que significa indivisible, los átomos están formados por partículas aún más pequeñas, las partículas subatómicas.
 Generalmente, estas partículas subatómicas con las que están formados los átomos son tres: los electrones, losprotones y los neutrones. Lo que diferencia a un átomo de otro es la relación que se establecen entre ellas.
Generalmente, estas partículas subatómicas con las que están formados los átomos son tres: los electrones, losprotones y los neutrones. Lo que diferencia a un átomo de otro es la relación que se establecen entre ellas.
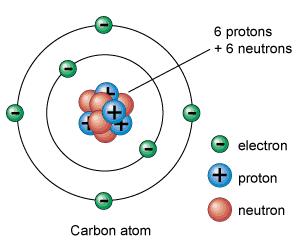
Los electrones tienen una carga negativa y son las partículas subatómicas más livianas que tienen los átomos. La carga de los protones es positiva y pesan unas 1.836 veces más que los electrones. Los únicos que no tienen carga eléctrica son los neutrones que pesan aproximadamente lo mismo que los protones.
Los protones y neutrones se encuentran agrupados en el centro del átomo formado el núcleo atómico del átomo. Por este motivo también se les llama nucleones. Los electrones aparecen orbitando alrededor del núcleo del átomo.
De este modo, la parte central del átomo, el núcleo atómico, tiene una carga positiva en la que se concentra casi toda su masa, mientras que en el escorzo a, alrededor del núcleo atómico, hay un cierto número de electrones, cargados negativamente. La carga total del núcleo atómico (positiva) es igual a la carga negativa de los electrones, de modo que la carga eléctrica total del átomo sea neutra.
Esta descripción de los electrones orbitando alrededor del núcleo atómico corresponde al sencillo modelo de Bohr. Según la mecánica cuántica cada partícula tiene una función de onda que ocupa todo el espacio y los electrones no se encuentran localizados en órbitas aunque la probabilidad de presencia sea más alta a una cierta distancia del núcleo.
Propiedades de los átomos
Las unidades básicas de la química son los átomos. Durante las reacciones químicas los átomos se conservan como tales, no se crean ni se destruyen, pero se organizan de manera diferente creando enlaces diferentes entre un átomo y otro.
Los átomos se agrupan formando moléculas y otros tipos de materiales. Cada tipo de molécula es la combinación de un cierto número de átomos enlazados entre ellos de una manera específica.
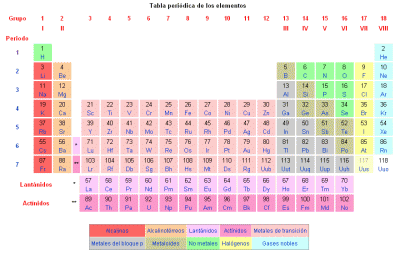
Según la composición de cada átomo se diferencian los distintos elementos químicos representados en la tabla periódica de los elementos químicos. En esta tabla podemos encontrar el número atómico y el número másico de cada elemento:
- Número atómico, se representa con la letra Z, indica la cantidad de protones que presenta un átomo, que es igual a la de electrones. Todos los átomos con un mismo número de protones pertenecen al mismo elemento y tienen las mismas propiedades químicas. Por ejemplo todos los átomos con un protón serán de hidrógeno (Z = 1), todos los átomos con dos protones serán de helio (Z = 2).
- Número másico, se representa con la letra A, y hace referencia a la suma de protones y neutrones que contiene el elemento. Los isótopos son dos átomos con el mismo número de protones, pero diferente número de neutrones. Los isótopos de un mismo elemento, tienen unas propiedades químicas y físicas muy parecidas entre sí.

¿QUÉ ES UNA MOLÉCULA?
La mayoría de lo que nos rodea está formada por grupos de átomos unidos que forman conjuntos llamados moléculas. Los átomos que se encuentra en una molécula se mantienen unidos debido a que comparten o intercambian electrones.
Las moléculas están hechas de átomos de uno o más elementos. Algunas moléculas están hechas de un sólo tipo de átomo. Por ejemplo, dos átomos de oxígeno se unen para formar una molécula de O2, la parte del aire que necesitamos para respirar y vivir. Otras moléculas son muy grandes y complejas. Por ejemplo, las moléculas de proteína contienen cientos de átomos.
Aún las moléculas muy grandes son tan pequeñas que no seríamos capaces de ver a una molécula de una sustancia. Pero cuando cientos de moléculas se encuentran juntas, podrían estar en forma de un vaso de agua, el árbol de un bosque, la pantalla de la computadora; dependiendo del tipo de moléculas que sean.
Aún cuando una pelota de futból esté inmóvil, las moléculas en ella se están moviendo constantemente. Quizás sean muy pequeñas para poder verlas, pero las moléculas están en constante movimiento, y se moverán más rapidamente a medida que la temperatura aumenta.

Molécula diatómica
Moléculas o compuestos diatómicos (del griego δι, dos y άτομον, átomo) son aquellos que están formados por dos átomos del mismoelemento químico. Este arreglo se debe a la existencia de un mínimo en el potencial al cual se encuentran sometidas los átomos. Aunque el prefijo di sólo significa dos, normalmente se sobrentiende que la molécula tiene dos átomos del mismo elemento. Los gases nobles no forman moléculas diatómicas: esto puede ser explicado usando la teoría orbital molecular. El potencial al que están sometidos los dos átomos y el que los mantiene unidos, cumple con las siguientes características: para  muy grandes este potencial se vuelve una constante, la cual se suele tomar como el origen de energía potencial; al
muy grandes este potencial se vuelve una constante, la cual se suele tomar como el origen de energía potencial; al  irse haciendo cada vez el más chico, el potencial decrece en el orden de
irse haciendo cada vez el más chico, el potencial decrece en el orden de  debido que están sometidos a fuerzas de tipo Van der Waals así que el potencial decrece muy rápido hasta alcanzar el punto mínimo el cual se encuentra a
debido que están sometidos a fuerzas de tipo Van der Waals así que el potencial decrece muy rápido hasta alcanzar el punto mínimo el cual se encuentra a  ; así que cuando
; así que cuando  entonces
entonces  . Es en sus primeros niveles energéticos muy similar al potencial del Oscilador armónico.
. Es en sus primeros niveles energéticos muy similar al potencial del Oscilador armónico.
 muy grandes este potencial se vuelve una constante, la cual se suele tomar como el origen de energía potencial; al
muy grandes este potencial se vuelve una constante, la cual se suele tomar como el origen de energía potencial; al  irse haciendo cada vez el más chico, el potencial decrece en el orden de
irse haciendo cada vez el más chico, el potencial decrece en el orden de  debido que están sometidos a fuerzas de tipo Van der Waals así que el potencial decrece muy rápido hasta alcanzar el punto mínimo el cual se encuentra a
debido que están sometidos a fuerzas de tipo Van der Waals así que el potencial decrece muy rápido hasta alcanzar el punto mínimo el cual se encuentra a  ; así que cuando
; así que cuando  entonces
entonces  . Es en sus primeros niveles energéticos muy similar al potencial del Oscilador armónico.
. Es en sus primeros niveles energéticos muy similar al potencial del Oscilador armónico.
El libro de Huber y Gerhard Herzberg, reeditado por Iñaki Etcheverry, Molecular Spectra and Molecular Structure IV. Constants of Diatomic Molecules1 (Wikipedia en inglés), lista cientos de moléculas diatómicas, algunas de las cuales se han detectado espectroscópicamente en el espacio interestelar. No obstante, de todas estas, sólo algunas se encuentran en la naturaleza aunque representan casi la totalidad de la atmósfera terrestre: dinitrógeno (78%), dioxígeno (21%), argón (0.9340%). El oxígeno también aparece en forma de molécula triatómica con el nombre de ozono (O3).
Elementos diatómicos son aquellos que prácticamente existen exclusivamente como moléculas diatómicas, son conocidas como moléculas diatómicas homonucleares cuando en su estado natural no están químicamente enlazados con otro elemento. Entre los ejemplos más comunes encontramos el H2 y el O2.

jueves, 27 de marzo de 2014
PROPORCIONALIDAD
En la vida corriente utilizamos el término PROPORCIÓN con distintos sentidos:
Cuando decimos que alguien está bien proporcionado damos a este término un sentido de armonía y estética: "este niño ha crecido mucho, pero está bien proporcionado"Actividades
También se cometen errores:
- Si comentamos que el éxito de una persona es proporcional (o está en proporción) a su trabajo ponemos de manifiesto la correlación entre estas dos variables: ÉXITO y TRABAJO.
- También solemos utilizarlo para comparar fenómenos en distintos ámbitos: " proporcionalmente una hormiga es más fuerte que un elefante " (el hombre no resiste las comparaciones con otros animales: un
escarabajo puede levantar 850 veces el peso de su propio cuerpo. Proporcionalmente equivaldría a que un hombre levantara sobre su cabeza un tanque de 50 Tm. Una pulga puede saltar hasta 130 veces su altura. Para competir con ella un hombre debería saltar limpiamente la Giralda de Sevilla).
En matemáticas esta palabra tiene un significado más restringido que trataremos de precisar:Consideremos los siguientes ejemplos:
- Hace años se estudió la reacción de un elefante macho al LSD (una droga). Los científicos calcularon la dosis que se debía administrar a partir de la cantidad que pone a un gato en estado furioso. Esta proporción fue trágica para el elefante pues inmediatamente empezó a correr y a trompetear, tuvo convulsiones y expiró.
Ejemplo 1En la siguiente tabla se relaciona la superficie de una valla a pintar y la pintura empleada.
Ejemplo 2Desde que un conductor ve un obstáculo, reacciona, pisa el freno y el coche realmente se detiene, se recorre una distancia que depende de la velocidad:
m2 de valla a pintar
Litros de pintura empleados
Ejemplo 3Observa el dibujo y construye una tabla que relacione la altura de cada rectángulo con su base.
Velocidad que lleva (Km/h)
Distancia total de detención (m)
Ejemplo 4
El precio de un aparcamiento es:
En todos estos ejemplos existe una relación entre dos magnitudes. Además, cuando una varía provoca que varíe la otra. Podemos precisar aún más:
Tiempo
Precio
En el ejemplo 1:
- Al doble de m2 de valla corresponde doble cantidad de litros de pintura.
- Al triple de m2 de valla corresponde triple cantidad de litros de pintura.
- A la mitad de m2 de valla corresponde la mitad cantidad de litros de pintura.
En el ejemplo 3:
- A doble base corresponde doble altura.
- A triple base corresponde triple altura.
- A cuádruple base corresponde .... altura.
"La superficie de valla a pintar es directamente proporcional al volumen de litros de pintura".
a doble .............. doble,a mitad.............. mitad,a triple ............. triple,a un tercio.....un tercio,etc .........................
decimos que las dos magnitudes son directamente proporcionales.
"Las longitudes de las bases son directamente proporcionales a las longitudes de las alturas".
En el ejemplo 4 es conveniente observar que si sólo tomamos valores enteros puede parecer que existe proporcionalidad. No es así, como ponen de manifiesto los siguientes valores:
En este caso diremos que el precio del estacionamiento no es directamente proporcional al tiempo aparcado.
¿ Y el ejemplo 2 ? Averígualo.
Proporcionalidad y tablas. Regla de tres¿Cómo reconocer una proporcionalidad directa con tablas?
Esta tabla es de proporcionalidad directa.
Observa:
Al multiplicar un valor de la 1ª serie por un número, el valor de la 2ª serie queda multiplicado por dicho número (o al revés), en consecuencia:
El cociente entre dos números correspondientes de cada serie es constante:
A esta constante ( en el caso anterior 0'25) lo llamaremos razón de proporcionalidad.
- De las siguientes tablas de valores, di cuáles corresponden a una proporcionalidad directa:
- Dibuja los segmentos correspondientes sabiendo que la razón de proporcionalidad es 3/4.

- Completa la serie de dibujos sabiendo que la razón de proporcionalidad es 2/3.

- ¿ Cuál es la razón de proporcionalidad ?

- Un estudiante pesa algunas bolas de acero. He aquí los resultados:
Diámetro8 mm11 mm162125
Peso2'1 g5'5 g1738'464'9
- Vertemos diferentes cantidades de agua en un vaso cónico. En cada vertido medimos la altura del agua y su volumen:

¿ Es el volumen directamente proporcional a la altura ?
Regla de tres directaLas situaciones de proporcionalidad han dado lugar al aprendizaje de recetas conocidas con el nombre de reglas de tres: Si 5 Kg. de patatas cuestan 2'4 euros.¿Cuánto cuestan 7 Kg.?

Resolviendo:

¿ Por qué efectuamos así esta regla ?
Son magnitudes directamente proporcionales y por lo tanto, los cocientes son iguales:

En general, podemos hacer un esquema para dos magnitudes que sean directamente proporcionales:

No siempre merece la pena aplicar una regla de tres: Si con 10 litros de gasolina recorro 60 Km, con 80 l (8 veces 10 l) recorreré 8 veces más, es decir 8.60=240 Km.
Actividades - Completa la siguiente tabla de proporcionalidad:
2 5 4 2+5 5+4 5-2 2+5+6+4 3 9 6 - Demuestra las siguientes propiedades de las proporciones:a) Esta propiedad la utilizarás más tarde para resolver problemas de repartos. Si la tabla:
es una tabla de proporcionalidad directa (es decir, si se cumple quea b c a' b' c'  ), entonces la tabla
), entonces la tabla
también es de proporcionalidad directa ( y entonces también se cumple quea b c a+b+c a' b' c' a'+b'+c'  )
)
b) Si los números a, b, a', b' son tales que , entonces
, entonces 
c) Probar que:


Proporcionalidad y gráficas
¿Cómo reconocer una proporcionalidad directa a partir de una gráfica?
- Para comenzar realiza estas actividades:a) Traza unos ejes cartesianos y dibuja una gráfica con los datos del ejemplo 1.
b) Haz lo mismo con el ejemplo 3.
Observa la gráfica:

La altura del agua en la probeta es directamente proporcional al tiempo que permanece abierto el grifo.TRABAJOS

lunes, 24 de marzo de 2014
CHISTES CIENTIFICOS

1. Dos físicos teóricos se pierden en la cima de una montaña. El físico teórico Nº1 saca un mapa y lo examina un momento. Entonces se vuelve al físico teórico Nº2 y le dice: “Hey, ya lo resolví. Sé donde estamos”.
- ¿Entonces dónde estamos?
- ¿Ves esa montaña por allá?
- Sí.
- Bueno… ALLÁ es donde estamos.
(Chiste atribuido a un físico teórico ganador del premio Nobel para ejemplificar cuán desconectados de la realidad suelen estar en su profesión).
- ¿Entonces dónde estamos?
- ¿Ves esa montaña por allá?
- Sí.
- Bueno… ALLÁ es donde estamos.
2. Un electrón y un positrón entran en un bar.
Positrón: “Ya estás redondo”.
Electrón: ¿Estás seguro?”.
Positrón: “Positivo”.
3. Un grupo de adinerados inversionistas quería ser capaz de predecir el resultado de una carrera de caballos, así que contrataron a un grupo de biólogos, un grupo de estadísticos y un grupos de físicos. A cada uno se les dio un año para realizar sus investigaciones. Al concluir ese tiempo, todos los grupos se reportaron a los inversionistas.
Los biólogos dijeron que podían crear genéticamente a un caballo invencible, pero que les tomaría 200 años y 100.000 millones de dólares. Luego se reportaron los estadísticos, quienes afirmaron poder predecir el resultado de cualquier carrera, a un costo de 100 millones de dólares por carrera y con una probabilidad de éxito sólo del 10%. Finalmente, se reportan los físicos teóricos, quienes aseguraron poder predecir el resultado de cualquier carrera a través de un proceso simple y económico.
Los inversionistas pidieron ansiosamente más detalles de la propuesta. Entonces, el líder de los físicos indicó: “Hicimos algunas presunciones simplificadoras: primero, asumamos que cada caballo es una esfera perfecta…”
4. ¿Por qué Erwin Schrödinger, Paul Dirac y Wolfgang Pauli trabajan en garages tan pequeños? Porque son mecánicos cuánticos.
5. ¿Qué significa ADN? Asociación Nacional de Disléxicos.
6. Un nuevo monje llega a un monasterio donde los monjes pasan sus vidas haciendo copias de libros antiguos. El nuevo monje fue al sótano del monasterio advirtiendo que prefería hacer copias de los originales en vez de copias de otros para evitar duplicar los errores que éstos pudieron haber cometido. Varias horas después, los monjes salieron en su busca preguntándose dónde se habría metido su nuevo amigo. Lo encontraron llorando en un rincón del sótano. Al preguntarle qué sucedía, este respondió: “¡La palabra era SILBATO, no CELIBATO!”.
7. Identificaron el gen de la timidez. Pudieron haberlo hallado antes, pero estaba oculto entre otros dos genes.
8. ¿Por qué la gallina cruzó la cinta de Möbius? Para llegar al otro… ¿eh?… esperen un momento…
9. Un estadístico es alguien que, cuando tienes la cabeza en el refrigerador y los pies en el horno, te dice que -en promedio- te encuentras bastante a gusto.
10. En una fiesta de funciones, la e^x se queda en la barra con aspecto deprimido. El barman le dice: “¿Por qué no vas y te integras?”, a lo que la e^x responde, “¿qué diferencia haría?”.
11. Existen 10 tipos de personas: las que entienden binario y las que no.
12. Un estadístico tuvo gemelos, pero sólo bautizó a uno de ellos. Quería conservar al otro como control.
13. Un profesor de química es reclutado como operador de radio en la Primera Guerra Mundial. Pronto se familiariza con la costumbre militar de abreviarlo todo. Así, cuando su unidad cae bajo ataque sorpresa, le piden informarlo con urgencia al cuartel general. “¡NaCl sobre NaOH! ¡NaCl sobre NaOH!”, dice. “¿NaCl sobre NaOH? -le grita su superior – ¿qué demonios es eso?”. “¡La base está bajo a-sal-to!”, responde.
14. Un investigador en botánica entra a una ferretería y pregunta: “Oiga, ¿tiene algún inhibidor de 3-fosfoshikimato-carboxyvinilo transferasa?”. El vendedor le dice: “¿Se refiere a desmalezador?”. El científico: “Eso mismo. Nunca puedo recordar ese maldito nombre”.
15. Un psicoanalista le muestra a un paciente una mancha de tinta y le pregunta qué es lo que ve. El paciente responde: “Veo un hombre y una mujer haciendo el amor”. El psicoanalista le muestra una segunda mancha y el paciente dice: “También hay un hombre y una mujer haciendo el amor”. El psicoanalista entonces le dice: “Usted está obsesionado con el sexo”, a lo que su paciente replica: “¿A qué se refiere con que soy yo el obsesionado? Usted es el que me ha estado mostrando dibujos cochinos”.
16. Tras el sexo, un psicólogo conductista le dice al otro: “Eso estuvo maravilloso para ti. ¿Cómo estuvo para mí?”.
Positrón: “Ya estás redondo”.
Electrón: ¿Estás seguro?”.
Positrón: “Positivo”.
lunes, 10 de marzo de 2014
FORMAS DE LA MATERIA
Concepto físico
En física, se llama materia a cualquier tipo de entidad que es parte del universo observable, tiene energía asociada, es capaz de interaccionar, es decir, es medible y tiene una localización espaciotemporal compatible con las leyes de la naturaleza.
Clásicamente se considera que la materia tiene tres propiedades que juntas la caracterizan: ocupa un lugar en el espacio, tiene masa y perdura en el tiempo.
En el contexto de la física moderna se entiende por materia cualquier campo, entidad, o discontinuidad traducible a fenómeno perceptible que se propaga a través del espacio-tiempo a una velocidad igual o inferior a la de la luz y a la que se pueda asociar energía. Así todas las formas de materia tienen asociadas una cierta energía pero sólo algunas formas de materia tienen masa.
Materia másica

 Los constituyentes básicos de la materia másica conocida son los fermiones como los "quarks" (púrpura) y "leptones" (verde). Los bosones (rojo) son "materia no-másica".
Los constituyentes básicos de la materia másica conocida son los fermiones como los "quarks" (púrpura) y "leptones" (verde). Los bosones (rojo) son "materia no-másica".Artículo principal: Materia (física)
La materia másica está jerárquicamente organizada en varios niveles y subniveles. La materia másica puede ser estudiada desde los puntos de vista macroscópico y microscópico. Según el nivel de descripción adoptado debemos adoptar descripciones clásicaso descripciones cuánticas. Una parte de la materia másica, concretamente la que compone los astros subenfriados y las estrellas, está constituida por moléculas, átomos, e iones. Cuando las condiciones de temperatura lo permite la materia se encuentra condensada.
Nivel microscópico
El nivel microscópico de la materia másica puede entenderse como un agregado de moléculas. Éstas a su vez son agrupaciones de átomos que forman parte del nivel microscópico. A su vez existen niveles microscópicos que permiten descomponer los átomos en constituyentes aún más elementales, que sería el siguiente nivel son:
Electrones: partículas leptónicas con carga eléctrica negativa.
Protones: partículas bariónicas con carga eléctrica positiva.
Neutrones: partículas bariónicas sin carga eléctrica (pero con momento magnético).
A partir de aquí hay todo un conjunto de partículas subatómicas que acaban finalmente en los constituyentes últimos de la materia. Así por ejemplo virtualmente los bariones del núcleo (protones y neutrones) se mantienen unidos gracias a un campo escalar formado por piones (bosones de espín cero). E igualmente los protones y neutrones, sabemos que no son partículas elementales, sino que tienen constituyentes de menor nivel que llamamos quarks (que a su vez se mantienen unidos mediante el intercambio de gluonesvirtuales).
Nivel macroscópico
Macroscópicamente, la materia másica se presenta en las condiciones imperantes en el sistema solar, en uno de cuatro estados de agregación molecular: sólido, líquido, gaseoso y plasma. De acuerdo con la teoría cinética molecular la materia se encuentra formada por moléculas y éstas se encuentran animadas de movimiento, el cual cambia constantemente de dirección y velocidad cuando chocan o bajo el influjo de otras interacciones físicas. Debido a este movimiento presentan energía cinética que tiende a separarlas, pero también tienen una energía potencial que tiende a juntarlas. Por lo tanto el estado físico de una sustancia puede ser:
Sólido: si la energía cinética es menor que la potencial.
Líquido: si la energía cinética y potencial son aproximadamente iguales.
Gaseoso: si la energía cinética es mayor que la potencial.
Plasma: si la energía cinética es tal que los electrones tienen una energía total positiva.
Bajo ciertas condiciones puede encontrarse materia másica en otros estados físicos, como el condensado de Bose-Einstein o el condensado fermiónico.
La manera más adecuada de definir materia másica es describiendo sus cualidades:
Presenta dimensiones, es decir, ocupa un lugar en un espacio-tiempo determinado.
Presenta inercia: la inercia se define como la resistencia que opone la materia a modificar su estado de reposo o movimiento.
La materia es la causa de la gravedad o gravitación, que consiste en la atracción que actúa siempre entre objetos materiales aunque estén separados por grandes distancias.
Materia no-másica
Una gran parte de la energía del universo corresponde a formas de materia formada por partículas o campos que no presentan masa, como la luz y la radiación electromagnética, las dos formada por fotones sin masa. Junto con estas partículas no másicas, se postula la existencia de otras partículas como el gravitón, el fotino y el gravitino, que serían todas ellas partículas sin masa aunque contribuyen a la energía total del universo.
Distribución de materia en el universo
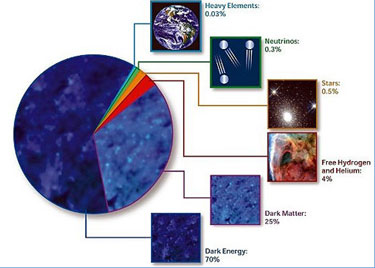
 Según estimaciones recientes, resumidas en este gráfico de la NASA, alrededor del 70% del contenido energético del Universo consiste en energía oscura, cuya presencia se infiere en su efecto sobre la expansión del Universo pero sobre cuya naturaleza última no se sabe casi nada.
Según estimaciones recientes, resumidas en este gráfico de la NASA, alrededor del 70% del contenido energético del Universo consiste en energía oscura, cuya presencia se infiere en su efecto sobre la expansión del Universo pero sobre cuya naturaleza última no se sabe casi nada.Según los modelos físicos actuales, sólo aproximadamente el 5% de nuestro universo está formado por materia másica ordinaria. Se supone que una parte importante de esta masa sería materia bariónica formada por bariones y electrones, que sólo supondrían alrededor de 1/1850 de la masa de la materia bariónica. El resto de nuestro universo se compondría de materia oscura (23%) y energía oscura (72%).
A pesar que la materia bariónica representa un porcentaje tan pequeño, la mitad de ella todavía no se ha encontrado. Todas las estrellas, galaxias y gas observable forman menos de la mitad de los bariones que debería haber. La hipótesis principal sobre el resto de materia bariónica no encontrada es que, como consecuencia del proceso de formación de estructuras posterior al big bang, está distribuida en filamentos gaseosos de baja densidad que forman una red por todo el universo y en cuyos nodos se encuentran los diversos cúmulos de galaxias. Recientemente (mayo de 2008) el telescopio XMM-Newton de la agencia espacial europea ha encontrado pruebas de la existencia de dicha red de filamentos.
Propiedades de la materia ordinaria
Propiedades generales
Las presentan los cuerpos sin distinción y por tal motivo no permiten diferenciar una sustancia de otra. Algunas de las propiedades generales se les da el nombre de extensivas, pues su valor depende de la cantidad de materia, tales el caso de la masa, peso, volumen, la inercia, la energía, impenetrabilidad, porosidad, divisibilidad, elasticidad, maleabilidad, tenacidad y dureza entre otras.
Propiedades características
Permiten distinguir una sustancia de otra. También reciben el nombre de propiedades intensivas porque su valor es independiente de la cantidad de materia. Las propiedades características se clasifican en:
Físicas
Es el caso de la densidad, el punto de fusión, el punto de ebullición, el coeficiente de solubilidad, el índice de refracción, el módulo de Young y las propiedades organolépticas.
Químicas
Están constituidas por el comportamiento de las sustancias al combinarse con otras, y los cambios con su estructura íntima como consecuencia de los efectos de diferentes clases de energía.
Ejemplos:
corrosividad de ácidos
poder calorífico
acidez
reactividad
Ley de la conservación de la materia
Como hecho científico la idea de que la masa se conserva se remonta al químico Lavoisier, el científico francés considerado padre de la Química moderna que midió cuidadosamente la masa de las sustancias antes y después de intervenir en una reacción química, y llegó a la conclusión de que la materia, medida por la masa, no se crea ni destruye, sino que sólo se transforma en el curso de las reacciones. Sus conclusiones se resumen en el siguiente enunciado: En una reacción química, la materia no se crea ni se destruye, solo se transforma. El mismo principio fue descubierto antes por Mijaíl Lomonosov, de manera que es a veces citado como ley de Lomonosov-Lavoisier, más o menos en los siguientes términos: La masa de un sistema de sustancias es constante, con independencia de los procesos internos que puedan afectarle, es decir, "La suma de los productos, es igual a la suma de los reactivos, manteniéndose constante la masa". Sin embargo, tanto las técnicas modernas como el mejoramiento de la precisión de las medidas han permitido establecer que la ley de Lomonosov-Lavoisier, se cumple sólo aproximadamente.
La equivalencia entre masa y energía descubierta por Einstein obliga a rechazar la afirmación de que la masa convencional se conserva, porque masa y energía son mutuamente convertibles. De esta manera se puede afirmar que la masa relativista equivalente (el total de masa material y energía) se conserva, pero la masa en reposo puede cambiar, como ocurre en aquellos procesos relativísticos en que una parte de la materia se convierte en fotones. La conversión en reacciones nucleares de una parte de la materia en energía radiante, con disminución de la masa en reposo; se observa por ejemplo en procesos de fisión como la explosión de una bomba atómica, o en procesos de fusión como la emisión constante de energía que realizan las estrellas.
Concepto filosófico
Desde el comienzo de la filosofía, y en casi todas las culturas, se encuentra este concepto vagamente formulado como lo que permanece por debajo de las apariencias cambiantes de las cosas de la naturaleza. Según esa idea, todo lo observable está dado en sus diversas y cambiantes apariencias en un soporte o entidad en la que radica el movimiento y cambio de las cosas: la materia.
Principio único o diversos
Una cuestión filosófica importante fue si toda la materia o sustrato material tenía un principio único o tenía diversas fuentes. Que dicho sustrato sea uno sólo, o varios principios materiales, (aire, fuego, tierra y agua), fue cuestión planteada por los filósofos milesios; los eleatas, en cambio, cuestionaron la realidad del movimiento y, junto con los pitagóricos, fundamentaron el ser en un principio formal del pensamiento, dejando a la materia meramente como algo indeterminado e inconsistente, un no-ser.
El atomismo
Mayor trascendencia histórica ha tenido la teoría atomista de la antigüedad, puesta de nuevo en vigor por el mecanicismo racionalista en el siglo XVII y XVIII, que supuso el soporte teórico básico para el nacimiento de la ciencia física moderna.
Hilemorfismo
Platón y sobre todo Aristóteles elaboraron el concepto de forma, correlativo y en contraposición a la materia, dándole a ésta el carácter metafísico y problemático que ha tenido a lo largo de la historia del pensamiento, al mismo tiempo que ha servido como concepto que se aplica en otros contextos.
Es Aristóteles quien elaboró el concepto de materia de manera más completa, si bien el aspecto metafísico quedó relegado a la escolástica.
Para Aristóteles, siguiendo la tradición de los milesios y de Platón, la característica fundamental de la materia es la receptividad de la forma. La materia puede ser todo aquello capaz de recibir una forma. Por eso ante todo la materia es potencia de ser algo, siendo el algo lo determinado por la forma.
En función de este concepto hay tantas clases de materias como clases de formas capaces de determinar a un ser. Puesto que el movimiento consiste en un cambio de forma de la sustancia, el movimiento se explica en función de la materia como potencia y el acto como forma de determinación de la sustancia.
La materia, en tanto que sustancia y sujeto, es la posibilidad misma del movimiento. Hay tantas clases de materia cuantas posibles determinaciones de la sustancia en sus predicados.
Cuando las determinaciones son accidentales la materia viene dada por la situación de la sustancia en potencia respecto a recepción de una nueva forma. Así el estar sentando en acto es materia en potencia para estar de pie; el movimiento consiste en pasar de estar de pie en potencia, a estar de pie en acto.
El problema es la explicación del cambio sustancial que se produce en la generación y corrupción de la sustancia. Aparece aquí el concepto metafísico de materia prima, pura potencia de ser que no es nada, puesto que no tiene ninguna forma de determinación.
La tradicional fórmula escolástica por la que se suele definir la materia prima da idea de que realmente es difícil concebir una realidad que se corresponda con dicho concepto: No es un qué (sustancia), ni una cualidad, ni una cantidad ni ninguna otra cosa por las cuales se determina el ser. Una definición meramente negativa que incumple las leyes mismas de la definición. Pura posibilidad de ser que no es nada.
Sin embargo el concepto aristotélico de materia ha tenido aplicaciones en diversos sentidos.
Concepto de materia en otros contextos
Materia y Alma - Cuerpo y Espíritu
Una de las formas de consideración de la materia ha sido en su oposición con el alma. Según esta oposición la materia hace referencia a lo "inerte", lo que no tiene vida.
En esta oposición el alma denota principio de "vida" como capacidad de automovimiento y en el caso de los animales, al menos los animales superiores, capacidad de conciencia; siendo exclusivo del hombre la capacidad de autoconciencia entendida como espíritu y libertad.
El hecho religioso ha concedido históricamente a esta oposición una dimensión cultural importantísima. Pero la ciencia, al prescindir de cualquier dimensión metafísica o religiosa, no puede hacerse eco de esta distinción.
Ciencias materiales y ciencias formales
Las matemáticas y la lógica son ciencias formales porque no tienen ningún objeto material de estudio sino la “formas” válidas de inferencia. Por eso su mejor expresión es simbólica, sin contenido. Las demás ciencias en cuanto que tienen un objeto de estudio concreto son ciencias materiales.
Éticas materiales y éticas formales.
Kant introdujo lo que llamó éticas materiales y éticas formales. Las primeras consisten en establecer los imperativos acerca de lo que hay que hacer, es decir, tienen contenido. Las segundas no dicen lo que se tiene que hacer sino la “forma” en que se debe actuar en cualquier circunstancia.
Materia y forma en las obras artísticas
En las obras de arte, literatura, cine, pintura etc. suele distinguirse entre el contenido de que se trata y la forma en que el tema es tratado. Al primer aspecto se le considera como la materia y al segundo la forma propiamente dicha en la que consiste el arte.
Miscelánea
El kilogramo es una unidad de la cantidad de materia, corresponde a la masa de un dm³ (1 litro) de agua pura a 4 °C de temperatura. A partir de esta medida, se creó un bloque de platino e iridio de la misma masa que se denominó kilogramo patrón. Éste se conserva en la Oficina Internacional de Pesos y Medidas de Sèvres (Francia).
La cantidad de materia también puede ser estimada por la energía contenida en una cierta región del espacio, tal como sugiere la fórmula E = m.c² que da la equivalencia entre masa y energía establecida por la teoría de la relatividad de Albert Einstein.
"Tabla de densidades" en [kg/m3]: Osmio 22300, Oro 19300 - Hierro 7960 - Cemento 3000 - Agua 1000 - Hielo 920 - Madera 600 a 900 - Aire 1,29.
La temperatura es una magnitud que indica el grado de agitación térmica de una sustancia. Asimismo, cuando dos sustancias que están en contacto tienen distintas temperaturas se produce una transferencia de energía térmica (en forma de calor) hasta igualar ambas temperaturas. En el momento en que se igualan las temperaturas se dice que estas dos sustancias están en equilibrio térmico.
Los tres elementos químicos más abundantes en el universo son H, He y C; algunas de sus propiedades más importantes son:
Hidrógeno (H2): Densidad = 0,0899 kg/m³ Teb = -252,9 °C, Tf =-259,1 °C.
Helio (He): Densidad = 0,179 kg/m³ Teb = -268,9 °C, Tf = -272,2 °C.
Carbono (C): Densidad = 2267 kg/m³ Teb = 4027 °C, Tf = 3527 °C.
Suscribirse a:
Entradas (Atom)